近年来,过渡金属催化的偶联反应已成为现代有机合成中最重要的工具之一。通过氧化加成和还原消除来切断和形成共价键是过渡金属催化的一个重要方面,单独使用钯或镍催化的反应(如偶联、C-H键官能团化、氢化、还原以及氧化)在制药和精细化学品领域得到了广泛的应用。在过去的几十年里,研究人员优化了形形色色的催化剂,但就像“鱼与熊掌不可得兼”一样,如果催化剂的立体或电子性质有利于一个半循环,这些同样的性质往往也会抑制另一个半循环,这种固有的局限性降低了这些催化剂的效率。而且,两个半循环均困难的氧化加成和还原消除的催化反应通常无法进行,这阻碍了许多重要类型产物的直接合成。
钯催化的羰基化反应是制备高附加值羰基化合物的最有效途径之一,与类似的交叉偶联化学相比,CO配位对钯氧化加成的抑制作用需要更高的温度,而且限制了许多关键底物的使用(如活性较低的简单烷基卤代物)。值得注意的是,许多研究小组的开创性研究表明,将可见光催化剂与传统的镍或钯催化剂配对,可以加速偶联反应中一些挑战性的步骤,甚至可以通过光对钯催化剂的直接激发来实现。虽然这类策略扩大了催化作用的产物范围,但催化循环中的其它步骤仍然依赖于金属的空间和电子性质,并且可能受到热力学能垒的限制。
光能否在催化中扮演更重要的角色?它能否通过一种途径完全消除氧化加成和还原消除的平衡,并在相同的转化中驱动两者?
最近,加拿大麦吉尔大学的Bruce A. Arndtsen教授(点击查看介绍)课题组利用可见光对钯催化剂的激发,在低势垒下驱动了氧化加成和还原消除,也就是说,可以在室温条件下以一种通用的方式使具有挑战性的芳基或烷基卤化物和亲核试剂发生羰基化反应,生成高附加值的酰氯、酯、酰胺或酮等羰基衍生物。机理研究表明,钯(0)和钯(II)中间体的同时激发是该催化高活性的原因。相关成果发表于Science 上。
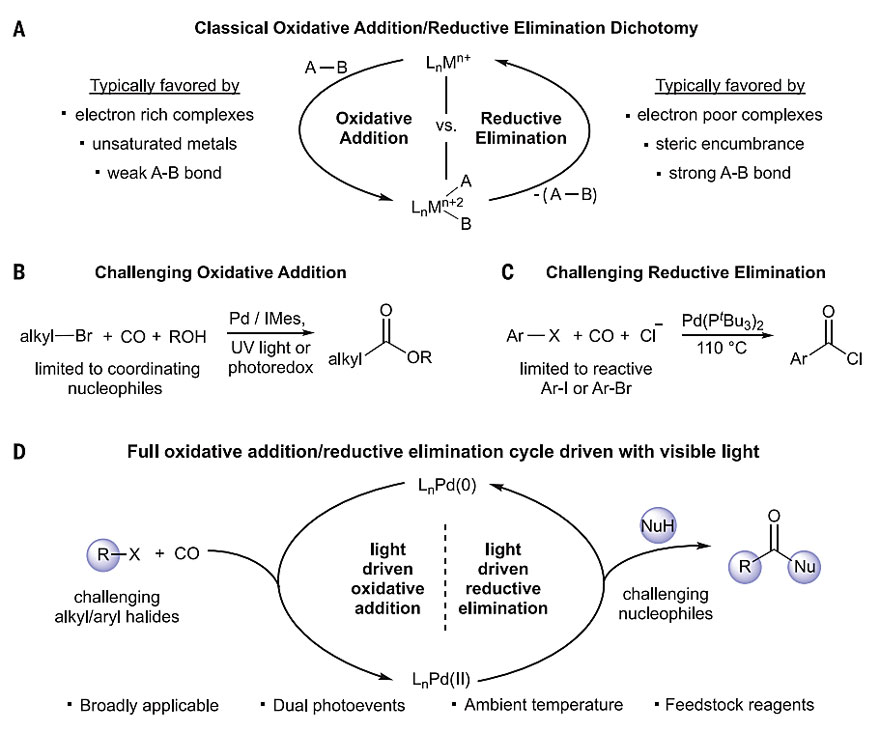
图1. 基于光策略的氧化加成-还原消除循环。图片来源:Science
作者以邻甲基碘苯为底物,在1当量Bu4NCl存在下进行羰基化反应,并使用2,6-二异丙基苯胺作为原位酰氯的捕获剂。在蓝光照射下,筛选了各种催化剂体系和光催化剂,值得注意的是,当使用Xantphos/[Pd(allyl)Cl]2和{Ir[dF(CF3)ppy]2(dtbpy)}PF6时,能够以34%的收率得到产物1a(图2A)。对照实验表明,无光催化剂时,仍能以相似的收率得到酰胺;在没有光,或绿光、红光照射,或无钯催化剂的情况下,未观察到反应进行;蓝光照射且不添加光催化剂时,大多数配体反应效果差,但使用DPEphos时,几乎以定量的收率在苯中得到酰胺1a(图2B);在没有胺参与下进行反应,生成了酰氯2a(图2C)。
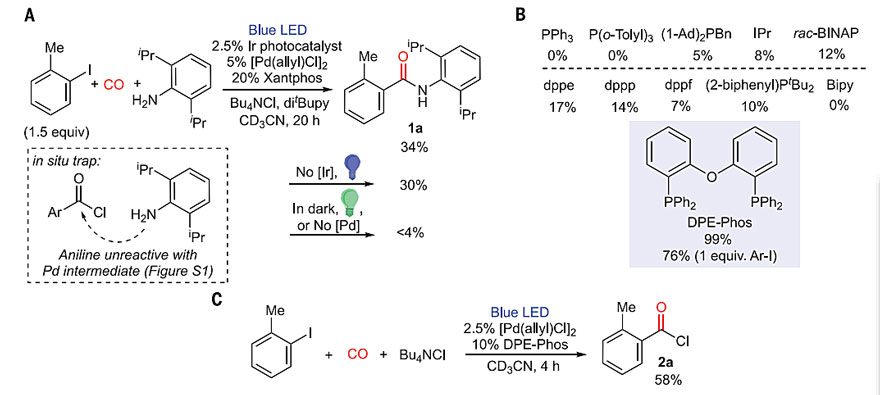
图2. 光和配体对Pd催化的羰基化反应的影响。图片来源:Science
在不添加光催化剂的情况下,室温下形成活性酰氯表明光在此系统中具有独特的作用,因为还原消除通常需要更加强烈的热力学条件(>100℃,高压CO)。为了进一步研究该产物的形成步骤,作者合成了DPEphos Pd(II)-酰基络合物3b-Cl,它能吸收蓝光(330 ~ 460 nm),即使是在低温照射下,也能在5 min内近乎定量还原消除生成酰氯2b(图3A)。在没有光照时,反应混合物恢复到3b-Cl和酰氯2b的1:1平衡态。因此,3b的激发似乎产生了一种不寻常的光稳定状态,从而驱动酰氯的生成。
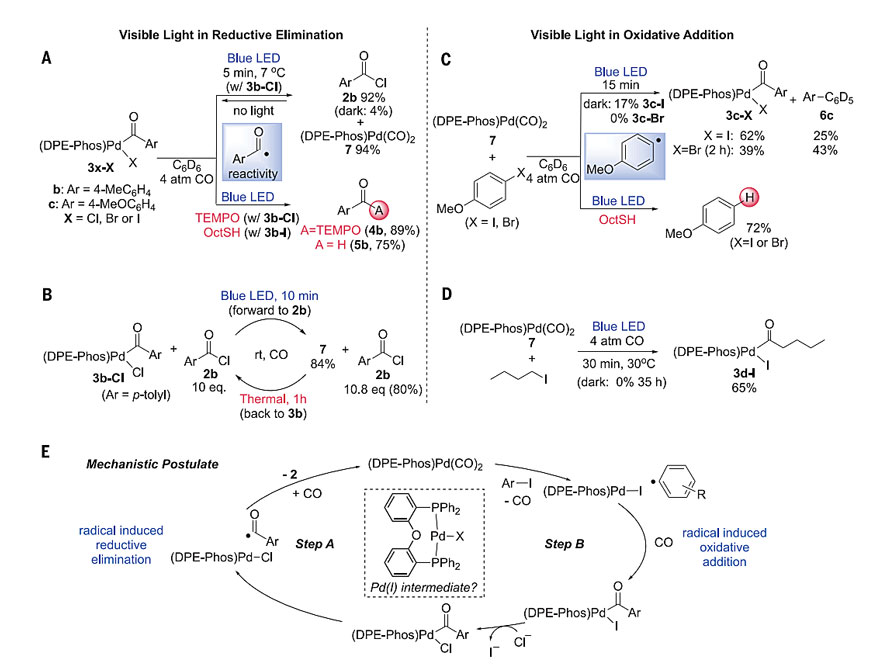
图3. 机理研究。图片来源:Science
随后,作者通过化学计量反应对这一还原消除步骤进行了进一步的研究。在1当量TEMPO存在下,对3b-Cl进行光照,可以快速形成酰基自由基捕获产物4b(图3A)。当硫醇存在时,酰基自由基攫取氢原子生成醛5b。控制实验均一致表明3在激发时形成酰基自由基,后续攫氯继续形成酰氯。如图3B所示,即使存在大量过剩的产物,光对这种自由基诱导的还原消除的加速影响足以驱动酰氯的形成,当无光照时,在1小时内便可定量地重新生成3b-Cl。
除了有利于还原消除外,光似乎还通过激发Pd(0)络合物(DPEphos)Pd(CO)2来参与氧化加成(图3)。对催化反应的混合物进行更仔细的分析后,作者观察到8%的联芳基化合物6a生成。Pd(0)络合物7是在酰氯消除后形成的,它可以吸收蓝光(300 ~ 420 nm)。此外,在芳基碘化物的存在下照射,快速发生逆向氧化加成形成3c-I和联芳基化合物(6c,图3C)。当硫醇作为氢原子供体时,可以抑制氧化加成,从而生成自由基捕获产物茴香醚(图3C)。这些数据支持了光诱导的单电子从Pd(0)转移到芳基碘化物的作用(图3E步骤B)。虽然芳基碘化物与7也可以发生缓慢的热反应,但芳基溴化物或烷基碘化物都不能发生热反应,但它们也能观察到类似的光诱导反应(图3C和D),这清晰地说明了可见光在氧化加成中的作用。
综上,这些实验结果表明光在该反应中扮演着两种不同的角色,尽管Pd(0)和可见光共同参与的自由基诱导的氧化加成反应已得到广泛的研究,但是光激发促进Pd(II)还原消除以及协同Pd(0)光化学的能力目前还尚未报道。正如前文提到,除了酰胺1a外,还生成了联芳基化合物6a,这表明在氧化加成中Pd(0)对芳基碘的光还原作用(图3A)。此外,在TEMPO存在下进行反应,催化作用被抑制并形成酰基自由基捕获产物4,它是由Pd(II)中间体3原位激发所产生的。对催化反应的NMR分析表明,络合物7是催化剂的稳定态,这与热化学相反,但与两个单独光解步骤的相对速率一致(图3)。
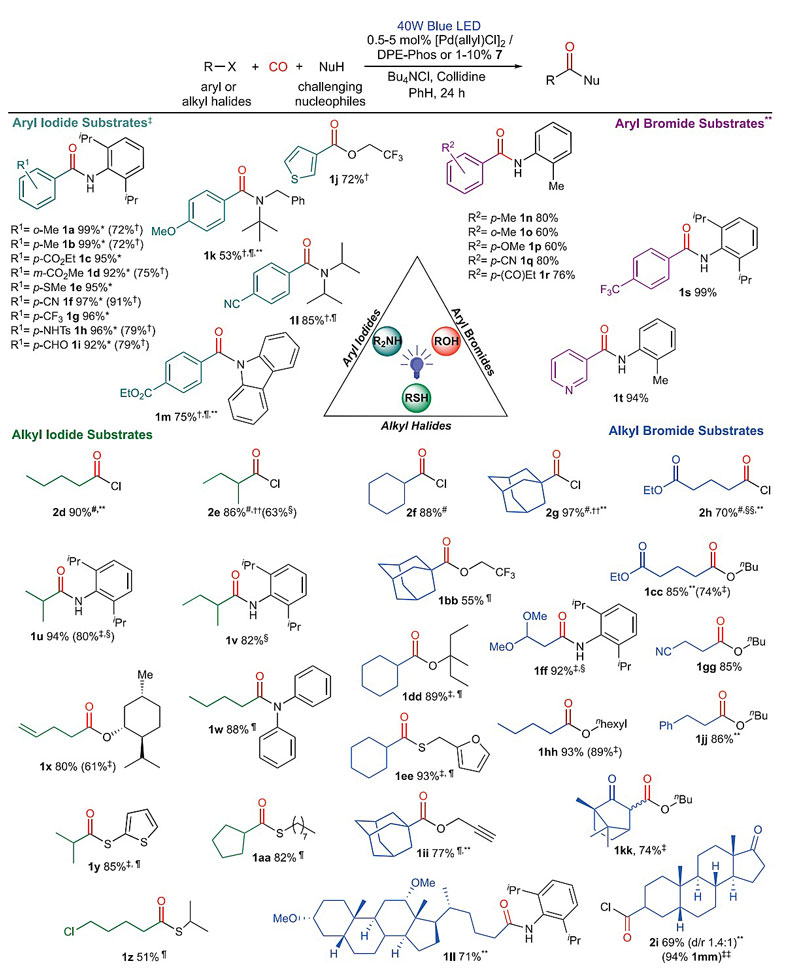
图4. 底物范围。图片来源:Science
在室温下,该催化系统可以对一些具有挑战性的亲电试剂和亲核试剂进行广泛的羰基化反应。邻、间和对位含有吸电子或供电子取代基的芳基碘化物均适用于该反应(1a-1i,图4),并且它对醛(1i)、保护的胺(1h)、酯(1c和1d)、腈(1f)、硫醚(1e)、甚至杂环(1j)等官能团都能兼容。通常情况下,芳基溴化物需要高温(100-120℃)才能生成酰氯,但该反应体系也可以在低至-3℃进行羰基化原位生成酰氯。与芳基碘化物相似,芳基溴化物也能够耐受多种取代基,例如甲氧基(1p)、腈(1q)、三氟甲基(1s)、酮(1r)以及杂环(1t)。
另外,这种光催化体系还可以通过羰基化途径将简单的卤代烷(烷基溴化物或碘化物)转化为有价值的烷基酰氯(2d-2i)。该反应对多种一级(1w、1ff、1hh)、二级(1u、1dd)、甚至三级(1bb、1ii)卤代烷均适用,并且对酯(1cc)、酮(1kk)、腈(1gg)、烷基氯(1z)等官能团均能兼容。而烷基氯化物在此条件下不反应。当碘甲基环丙烷为底物进行反应时,生成了开环的烯烃产物1x,这也支持了电子转移在氧化加成中的作用。鉴于在反应过程中形成了酰氯,因此大量的亲核试剂可以应用在此反应中,如取代的苯胺(1n-1r)、仲胺(1k和1l)、三级醇(1dd)甚至弱亲核性的氮杂环化合物(1m)。该反应还适用于更多元的底物组合(1y-1aa、1ii),也能生成结构上更复杂的产物(萜烯1kk、β-乙缩醛1ff、甾体2i),而经典的羰基化反应是无法生成的。

图5. 光驱动羰基化的应用。图片来源:Science
制备多肽类的重要试剂——β-氨基酸通常是由多步反应生成的,而该羰基化反应则开辟了一种直接生成β-氨基酸衍生物的方法(图5A);另外,芳烃、杂芳烃或卤代烷和CO生成的酰氯也可应用于Friedel-Crafts酰基化反应来合成取代酮(图5B);这种方法也可作为靶向合成的途径,如合成降低胆固醇的药物Fenofibrate(图5C)。
总结
Bruce A. Arndtsen课题组报道了一种可用于羰基偶联反应的多用途钯催化剂的替代策略,其中可见光对钯的激发可以驱动低势垒的氧化加成和还原消除,这一方法将被证明是创建有效催化剂系统的重要途径。
德国图宾根大学Prasad Kathe和Ivana Fleischer在同一期Science撰文 [1]评价道,Bruce A. Arndtsen等人的工作改变了催化循环的过程,使一些具有挑战性的底物在温和的反应条件下也可以发生转化。具体而言,将可见光作为外部工具来调节催化剂的性能,同时激发对氧化加成和还原消除都十分关键的催化剂中间体。该方法提供了一种简单而又充满创造力的合成工具,在均相催化领域中具有广阔的应用前景。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A dual light-driven palladium catalyst: Breaking the barriers in carbonylation reactions
Gerardo M. Torres, Yi Liu, Bruce A. Arndtsen
Science, 2020, 368, 318-323, DOI: 10.1126/science.aba5901
参考文献:
1. Light expands a catalyst's repertoire. Science, 2020, 368, 242-243, DOI: 10.1126/science.abb2104
https://science.sciencemag.org/content/368/6488/242
导师介绍
Bruce A. Arndtsen
https://www.x-mol.com/university/faculty/4599
(本文由有所不为供稿)
 实验外包
实验外包
 方案定制
方案定制
 仪器预约
仪器预约
 技术研发
技术研发
